腺相关病毒载体的制备与表征
来自:junmin 更新日期:2021/11/2 点击量: 3733
|
由于不插入宿主基因组、免疫原性低,同时宿主范围广、表达时程长、在体感染特异性好等特点,使腺相关病毒(adeno-associated virus,AAV)正成为广泛使用的基因治疗病毒载体之一。目前,已经有三款基于AAV载体的基因治疗药物上市,且有百多项AAV载体基因治疗临床试验在全球开展 。因此开发稳定的AAV病毒生产工艺对研发、临床研究及商品化都非常重要。
AAV的生产通常使用三质粒共转染法,三质粒系统在293T细胞中进行包装,然后采用机械或化学裂解的方法从细胞中收获AAV载体,细胞裂解后,可使用Benzonase处理,降低粘度,去除游离的核酸,对于科研级应用,传统采用密度梯度超速离心进行纯化,对于大规模培养,使用一次性生物反应器进行GMP级生产,收获阶段使用深层过滤或切向流过滤去除不溶性细胞成分,然后再用多步层析提高AAV载体纯度,在除菌过滤之前选择切向流过滤浓缩病毒载体,从而达到制剂浓度。在生产工艺中,丹纳赫旗下Pall及Cytiva具有质粒发酵及AAV载体制备的完整解决方案。
AAV载体的工艺流程解决方案
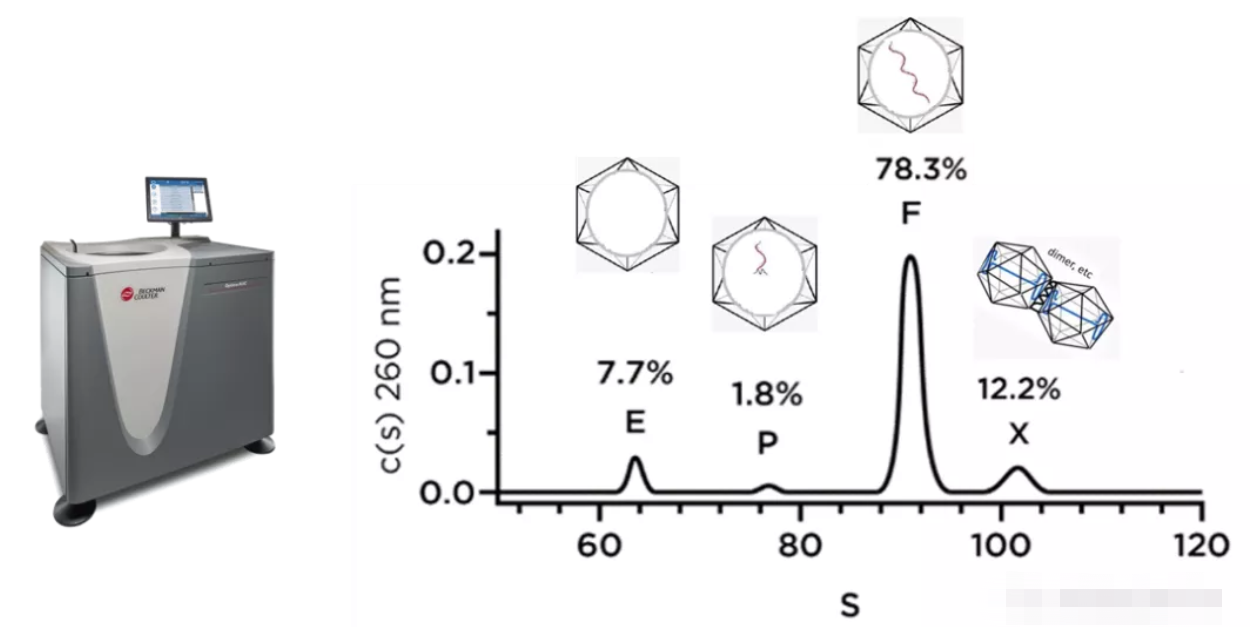
在AAV载体的生产工艺上,对载体生产的纯度有很高要求。AAV空病毒衣壳不含有治疗基因但会引起免疫反应,而且空衣壳会和完整衣壳竞争感染患者细胞,若要达到治疗效果就需要加大剂量,会带来高剂量副作用。所以用合适的方法检测AAV载体生产中的空壳率是也目前亟待解决的问题。采用贝克曼库尔特的分析型超速离心机AUC进行空壳率检测是有效的手段之一。由于AAV空衣壳与完整衣壳的分子量相差非常小,所以需要采用高分辨的方法进行检测。AUC采用沉降速率法,可区分及量化空载体、全基因组载体、部分组装载体、聚集状态的载体及其他杂质碎片等,且AUC方法不需要更换溶液体系及对样品进行标记,不会对样品造成破坏,并适用于不同血清型AAV载体。
AUC对rAAV颗粒状态进行检测(Wang et al. (2019). Mol Ther Methods Clin Dev, 15, 257-263.)
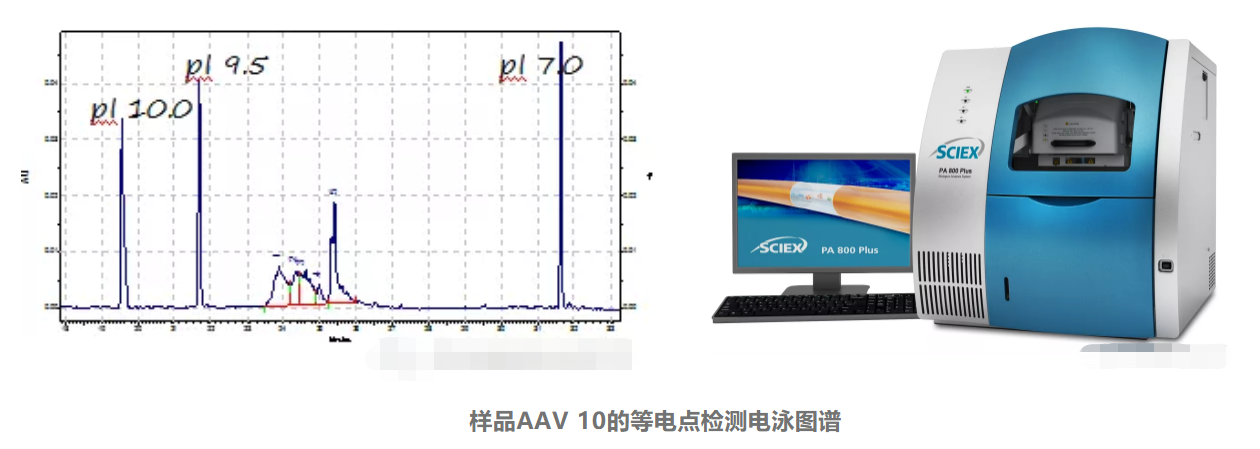
此外,SCIEX的PA800 Plus毛细管电泳制药分析系统亦可对AAV的不同组装状态进行分析。由于AAV衣壳表面的氨基酸侧链会造成AAV具有特定的等电点(Isoelectric Point,pI),其内部核酸的填充情况也会造成AAV等电点的差异,同时不同的血清型也可影响产品的等电点,所以通过用等电聚焦电泳模式对AAV载体进行pI值检测可用于AAV的种类鉴别及组装情况的分析。
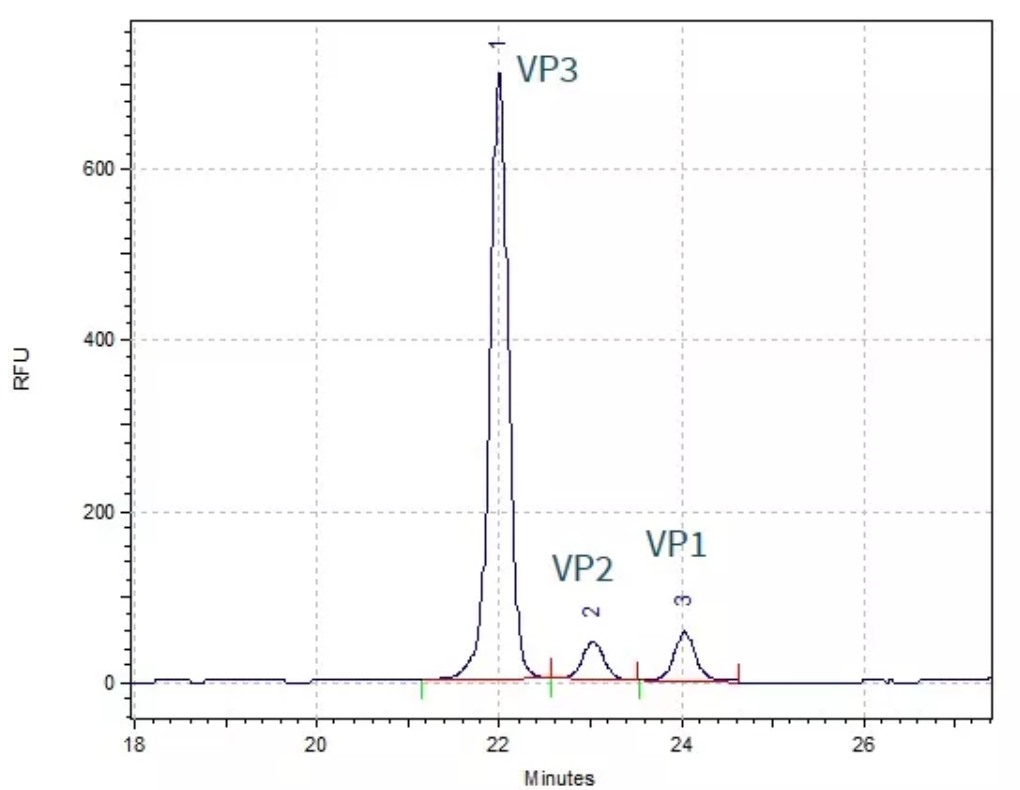
用毛细管电泳还可进行AAV的衣壳蛋白纯度分析及宿主细胞残留DNA(HCD)的片段分布检测。AAV衣壳由三种结构蛋白(VP1、VP2和VP3)组成,其比例和纯度都会影响药物的效能和效价,需要被鉴定并监控以确保药物质量,且AAV产品具有多种血清型,普遍浓度较低,需要一种针对不同血清型均具有较高分离度和灵敏度的分析方法。PA800 Plus采用激光诱导荧光的检测方式对AAV衣壳蛋白的结构蛋白进行纯度检测,可将VP1、VP2、VP3进行基线分离,检出限可达1×109 GC/mL。
CE-SDS-LIF方法分析AAV 10的衣壳蛋白纯度
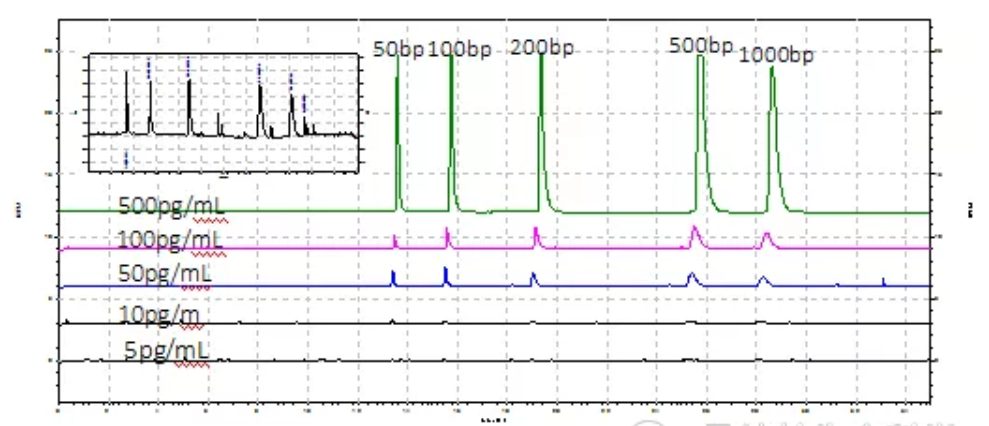
FDA关于人类基因治疗新产品生产指导文件中明确指出HCD的片段要小于200 bp;NMPA生物制品药学部同样在基因治疗产品药学研究与评价技术指导原则的征求意见稿中指出,HCD的片段要小于200 bp。PA800 Plus用激光诱导荧光的检测方式可检测10pg/mL的DNA片段浓度, 若在前处理的过程中对DNA进行浓缩处理,还可获得更高的检测灵敏度,同时可检测50bp-1000bp的片段大小,且可进行条件优化检测长至15kb的片段大小,满足各种残留DNA检测的要求。
PA800 Plus进行DNA片段标准品检测图谱
另外,病毒衣壳蛋白需要由正确的蛋白序列制成,并且它们通常需要加上特定的翻译后基团才能在细胞中充分发挥活性。这方面质量研究,可通过肽图分析方法进行检测。通过液相色谱与串联质谱联用(LC-MS / MS)可完成相关肽图分析,它可绘制出AAV颗粒在细胞中发挥正常功能所需的主要蛋白质序列和翻译后修饰信息。
高分辨质谱对AAV衣壳蛋白的序列覆盖度及翻译后修饰进行检测
腺相关病毒正成为基因治疗领域中非常重要的具有广泛应用前景的明星载体工具,丹纳赫生命科学具有从工艺到表征的完整解决方案,帮助用户应对AAV大规模生产中的挑战。
|