类器官如何在药物筛选领域发光发热?
来自:junmin 更新日期:2023/6/15 点击量: 3511
|
类器官是一种由干细胞或成体组织来源的多种细胞类型自组装形成的三维细胞结构,在体外能够长期存活并且可以模拟真实器官的结构和功能。类器官可以为药物开发和组织工程等应用提供快速且经济高效的模型,常用于疾病机制、药物筛选和再生医学等领域的研究[1]。类器官可以分为两大类,来源于胚胎干细胞(ESCs)或诱导多能干细胞(iPSCs)的体外分化产物和来源于成体组织中存在的干/祖细胞或成熟上皮细胞。类器官的发展经历了从单一细胞类型到多种细胞类型,从静态培养到动态灌流,从单一类器官到多种类器官互联等阶段。目前,科学家们已经成功构建了包括肝脏、肺脏、肾脏、心脏、胰腺、皮肤、眼睛等在内的多种类器官[2]
由于类器官技术具有时间短、成本低、生理相关度高等优势,近年来备受科学家的青睐,成为国际顶级学术期刊的座上宾。作为最大的一类酶联受体,酪氨酸激酶(RTKs)既是生长因子的受体,也能够催化下游靶蛋白的磷酸化。目前报道共有 58 种 RTKs ,可分为 20 个家族,包括大名鼎鼎的 EGFR 家族,EGFR 家族受体的异常激活与多种肿瘤相关,也是抗肿瘤药物研究的重要靶点[3]。结直肠癌(Colorectal cancer, CRC)是最常见的恶性肿瘤之一, CRC 的增殖和生存依赖于 RTK 信号通路中的 EGFR ,针对 EGFR 信号通路的抗体药物可以靶向阻断 RTK 信号通路,从而抑制肿瘤生长[4]。WNT(Wingless-Type MMTV Integration Site Family)信号通路在维持身体的稳态过程中发挥着重要功能,不仅参与调控细胞增殖、迁移、极性和死亡,也参与干细胞的效力维持和分化诱导。WNT 信号通路的异常激活与多种癌症包括 CRC 的发生有关[5]。结直肠癌干细胞(CSC)具有自我更新和分化能力,与结直肠肿瘤的发生、转移和治疗耐受有着密切的联系。科学家们将 CRC 中 CSC 的靶点作为抗体研发的方向,设计了靶向 WNT 和 RTK 通路的双特异性抗体(bAbs)MCLA-158 ,并研究了其在 CRC 来源的类器官上的有效性与安全性。该研究于 2022 年 4 月发表于《Nature Cancer》杂志上,标题为 “Functional patient-derived organoid screenings identify MCLA-158 as a therapeutic EGFR × LGR5 bispecific antibody with efficacy in epithelial tumors”(图 1)[6]。
图 1 相关文章
类器官来源于患者体内提取的样本,可以在实验室条件下生长,它们通过繁殖可以形成具有某些特性的肿瘤结构。医生为患者制定最佳治疗方案时,类器官可以提供极大的帮助,目前科学家们还在探索特定癌症药物研发过程中类器官的作用。抗体是由身体自然产生的蛋白质,可以用来识别感染因子或变异细胞,使它们被免疫系统的淋巴细胞(白细胞)清除[2]。这篇文章中,研究者利用来自多种上皮肿瘤的患者源类器官(PDOs)作为体外药物筛选平台,从亲和力、稳定性、配体阻断活性等方面鉴定出超过 500 个 WNT×RTK 双特异性抗体( bAbs),对 500 多种 bAbs 进行功能评价,寻找能够有效抑制肿瘤干细胞而不损伤正常干细胞的候选药物。科学家们发现了一种双特异性抗体(bAbs)MCLA-158 ,能够同时靶向 WNT 和 RTK 信号通路,特异性地识别并降解 EGFR ,从而抑制肿瘤干细胞的生长和存活,但对正常的结肠干细胞几乎没有毒性。在体外和体内模型中,MCLA-158 均可以有效地阻断肿瘤转移起始、延缓复发、并且抑制原发肿瘤的生长。
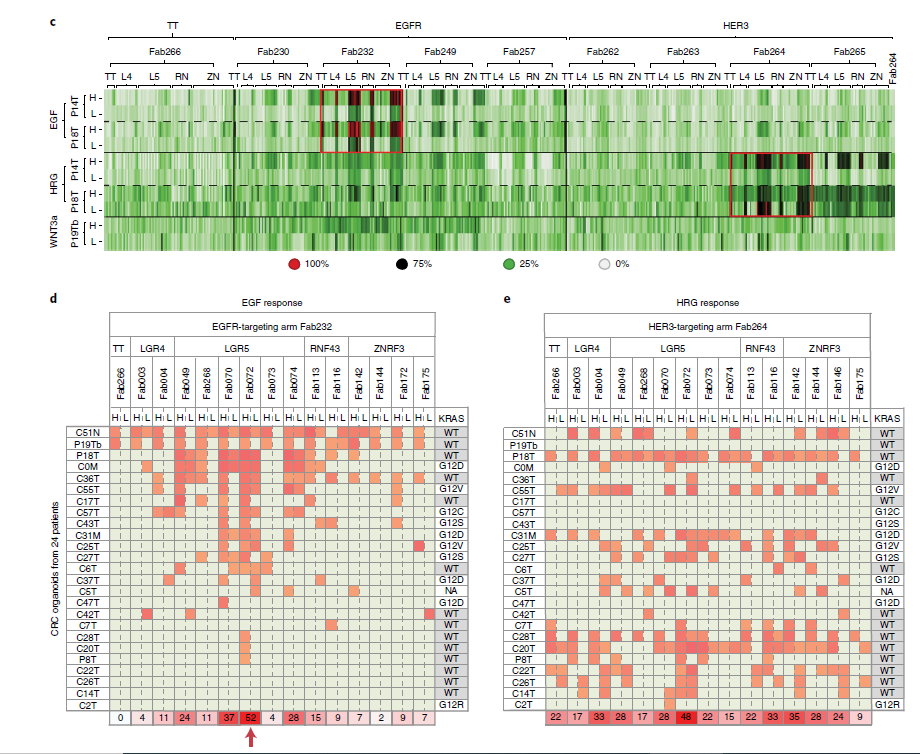
高内涵成像技术是一种利用自动化显微成像和图像分析软件对细胞、亚细胞或组织的形态、功能和相互作用进行定量和多参数分析的检测方法。高内涵成像技术可以提供丰富的信息,如细胞增殖、周期、死亡、信号通路、标志物表达、共定位等,适合药物筛选和毒性评价等领域的研究。本研究中,科学家们构建和培养了 CRC 患者来源的原发、肝转移、癌旁正常类器官(PDOs)库以及正常结肠黏膜样本(NCOs),对 500 多种 bAbs 进行功能评价,并且使用 Molecular Devices 高内涵成像分析系统对类器官进行药物筛选和功能评价。研究人员使用 ImageXpress 高内涵细胞成像分析系统(Molecular Devices),通过全自动高速显微成像,快速捕获类器官的图像。使用 ImageXpress Micro XLS 高内涵成像分析系统对类器官进行成像(图 2 及图 3),并通过 MetaXpress 图像分析软件,对类器官的形态变化、标志物表达、生长抑制率等参数进行量化分析(图 3)。使用 ImageXpress Micro Confocal 高内涵成像分析系统捕获类器官的共聚焦图片(图 4)。结果显示 MCLA-158 处理后, EGFR 与抗体共定位并呈点状分布在胞浆内,这表明 MCLA-158 可以将 EGFR 内化。通过高内涵成像系统,研究人员发现 MCLA-158 能够特异性地识别并降解 EGFR ,而且可以抑制 LGR5 标志的肿瘤干细胞的生长和存活。并且,MCLA-158 抗体不会干扰健康细胞的功能,这对维持组织的正常功能是至关重要的。
图 2 MCLA-158 特征
图 3 筛选患者源类器官(PDOs)的双特异性抗体(bAbs)
图 4 MCLA-158 或西妥昔单抗处理后 EGFR 内化和降解
在药物研发的早期阶段,使用类器官有助于识别对大多数患者有效的抗肿瘤药物。使用健康组织的类器官可以帮助研究人员评估药物对健康细胞的伤害和副作用,从而在研究的早期阶段筛选出毒性较大的抗体[6]。这篇文章展示了高内涵成像技术在类器官药物筛选中的应用和优势,为药物研发过程中对类器官的使用奠定了基础,也为基础医学和转化医学提供了新的思路和方法。
参考文献:
[1]. Jarno D, Hans C. Organoids in cancer research. Nature Reviews Cancer, 18, 407-418 (2018).
[2]. Aliya F, Si H T, et al. Organoids as an in vitro model of human development and disease. Nature Cell Biology, 18, 246-254 (2016).
[3]. Tomas M, Torkel V, et al. Protein tyrosine phosphatases and the immune response. Nature reviews Immunology, 5, 43-57 (2005).
[4]. Sandra M, Rona Y, et al. Emergence of KRAS mutations and acquired resistance to anti-EGFR therapy in colorectal cancer. Nature, 486, 532-536 (2012).
[5]. Mazieres J, He B, et al. Wnt signaling in cancer. Cancer Letters, 222, 1-10 (2005).
[6]. Herpers B, Eppink B, et al. Functional patient-derived organoid screenings identify MCLA-158 as a therapeutic EGFR x LGR5 bispecific antibody with efficacy in epithelial tumors. Nature cancer, 3, 418-436 (2022).
文章转载来源:美谷分子仪器 |