发光活性测定快速评估二维和三维乳腺癌模型系统的药物反应
来自:junmin 更新日期:2022/10/8 点击量: 4314
|
背景介绍 多年来,在平面培养板上生长的单层细胞模型(2D 模型)一直是研究疾病机制和评估潜在新药疗效的便捷系统,2D 生长的癌细胞系长久以来则是癌症模型的实验替代品。但近年来,癌细胞以及其他细胞类型,以三维(3D)格式培养能够形成多层结构,成为疾病研究的新模型。而这些模型在生物学上更具相关性。
虽然通常需要成像和高内涵分析来获得候选药物对复杂 3D 细胞模型影响的详细信息,但同时也需要直接的基于细胞的分析以评估单个参数,如整体细胞活力。三磷酸腺苷 ATP 检测是一种广泛使用的评估治疗手段对细胞活性影响的方法,在这个方法中,代谢活跃的细胞利用 ATP 作为能量来源;当营养物质受损或耗尽时,细胞会出现细胞质 ATP 的快速下降,用于测量 ATP 的分析方法通常是读取基于荧光素酶反应的发光读数。这个方法需要活细胞提供 ATP(图 1 ),并且由于细胞和试剂中缺乏背景发光,反应非常灵敏。ATP 检测的快速读数可用于快速筛选一大组化合物,并识别显著影响细胞活性的子集。然后,这个简化的集合可以应用于更集中的后续研究,包括提供更多表型细节的通量实验。
图一:荧光素酶反应用于测量细胞活力。细胞被溶解并加入荧光素酶反应,在那里它们提供产生发光所需的 ATP ,活细胞越多,产生的光信号就越多。
在这里,我们介绍一项小规模研究,是使用CellTiter Glo 3D 细胞活性分析试剂盒(Promega)测量的 2D 和 3D 细胞样本的细胞活性。我们分析了以下两种细胞类型的 2D 和 3D 细胞样本的活性,并用几种先前测试过的化合物进行了测试:MCF-7,一种常用的雌激素受体(ER)和孕酮受体(PR)阳性的乳腺癌细胞系;以及 TU-BcX-4IC,患者来源的肿瘤外植体,来作为三阴性(ER、PR 和 HER2 阴性)亚型化生性乳腺癌的代表模型。使用 SpectraMax iD5 微孔板读板器进行检测,该读板器具有超冷型 PMT ,可实现低背景发光和高灵敏度。所有数据均使用 SoftMax Pro 软件进行分析,包括曲线拟合和 IC50 计算。 实验材料
实验方法
3D 球体:MCF7 或 TU-BcX-4IC 细胞以每孔 2500 个细胞的量加入 384 孔 U 底微孔板,以 1000 rpm 离心平板 1 分钟聚集细胞,然后将培养板在 37°C、5%CO2 下培养 72 小时。 2D 单层培养:以每孔 5000 个细胞将 MCF7 接种到 384 孔平底微孔板中,然后在 37°C、5%CO2 下培养板 24 小时,TU-BcX-4IC 细胞以每孔 2500 个细胞进行培养,然后培养 48 小时。
以 2D 和 3D 培养的 TU-BcX-4IC 和 MCF7 细胞在四个重复的微孔中处理,以 1:5 梯度稀释 romidepsin 为 50 nM 至 0.006 nM。细胞与化合物在 37°C 、 5%CO2 下培养 72 小时。两种培养形式的 TU-Bcx-4IC 细胞也用硼替佐米、ibrutinib、盐酸依达比星、帕诺比诺和曲美替尼处理。细胞与化合物在 37°C、5%CO2 下培养 72 小时。
孵育后,将 CellTiter Glo 3D 试剂添加到样本孔中。对于 3D 球体,摇动平板 5 分钟,然后在室温下培养 30 分钟,以便在读数前进行细胞裂解。对于 2D 培养,将平板摇晃 2 分钟,然后在室温下培养 10 分钟,然后读取荧光值。使用表 1 所示的发光检测模式和设置,在 SpectraMax iD5 读板器上读取数值。所有数据分析和绘图均使用 SoftMax Pro 软件完成。
实验结果
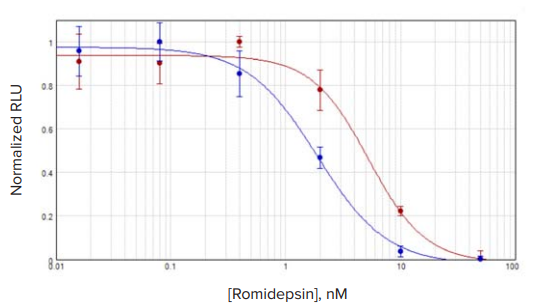
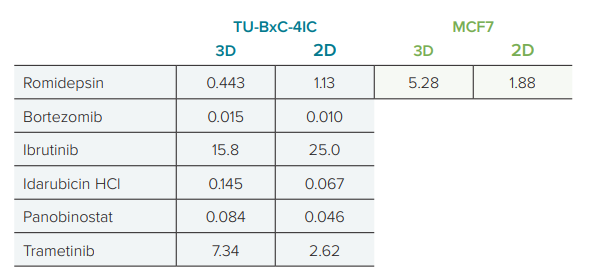
每组处理细胞的样本结果均使用 SoftMax Pro Software 中的 4 参数拟合,其中每条曲线的 C 参数被视为 IC50 值。在用 Romidepsin 处理的 MCF7 细胞中,3D 培养细胞的 IC50 浓度略高于单层培养细胞(图2)。与 2D 细胞相比,经 Romidepsin 处理的 TU-BcX-4IC 在 3D 培养细胞中的 IC50 稍低(图 2E)。对于其他测试的化合物,3D 培养细胞的 IC50 值通常更高,3D 和 2D 培养结果之间的差异通常约为两到三倍(图 3 ,表 2 )。
经 Romidepsin 处理的 TU-BxC-4IC 和 MCF7 细胞之间存在明显差异。在 2D 培养中,两种细胞类型的 IC50 值相似,分别为 1.13 nM 和 1.88 nM。然而,在 3D 培养中,TU-BxC-4IC 细胞的 IC50 值为 0.443 nM,比 MCF7 细胞的 5.28 nM 低 12 倍,这表明 TU-BcX-4IC 细胞培养方法对这些细胞的反应的影响比 MCF7 细胞的影响更大。 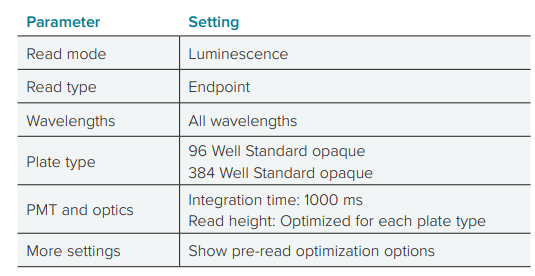 表一:CellTiter Glo 3D 分析的 SpectraMax iD5 读板器软件设置。具体设置在 SoftMax Pro 软件的板部分中指定。通过选中“更多设置”下的“显示预读取优化选项”旁边的框,并遵循启动读取后出现的说明,可以优化读取高度。 图二:3D 和 2D 培养 MCF7 细胞的化合物反应。以 3D(红色)和 2D(蓝色)培养的 MCF7 细胞,用罗美肽处理。3D 和 2D 的IC50 值分别为 5.28 nM 和 1.88 nM。 图三:三维和二维培养 TU-BcX-4IC 细胞的化合物反应。红色表示三维培养的细胞,而蓝色表示二维培养的细胞。A、 romidepsin 处理的细胞;B、 硼替佐米;C、 伊布替尼;D、 依达比星;E、 变阻器;F、 特拉梅蒂尼布。 表二:药物处理细胞的 IC50 值。列出了培养为球形(3D)或单层(2D)的 MCF7 和 TU-BcX-4IC 细胞的值。所示 IC50 浓度单位为 nM 。 实验结论
使用荧光素酶在不同实验条件下读取细胞内相对 ATP 浓度发光读数的分析为快速评估细胞活力提供了一种便捷方法。细胞可以放置在 U 形底板中,在那里它们很容易形成球体;并且可以进行药物处理和 ATP 检测,而无需清洗微孔或转移球体。由此得到的细胞活性数据本身需要通过其他方法(如高内涵成像)进行进一步研究的化合物或治疗方法。
在本应用文章中,我们证明了使用 CellTiter Glo 3D 分析比较不同化合物处理两种不同细胞类型(生长为球形或单层)的活性的结果的可行性。所述的细胞培养方法和检测方法易于建立,适合中高通量筛选。SpectraMax iD5 通过 SoftMax Pro Software 自动化的数据分析和曲线拟合,提供稳健分析读数所需的灵敏度。
|